|
LA FÉCONDATION IN VITRO
 | | |
La fécondation in vitro ou FIV (anciennement appelée FIVETE : fécondation in vitro et transfert d'embryon) est une technique d'aide médicale à la procréation (AMP) qui court-circuite les stades qui se déroulent normalement dans la trompe, c'est-à-dire la rencontre des ovocytes et des spermatozoïdes, la fécondation et les premières étapes du développement embryonnaire.
| | | Pour compléter les informations disponibles
sur cette page, vous pouvez vous
rendre sur le site suivant :
 | I – QUEL EST LE PRINCIPE DE LA FIV ?
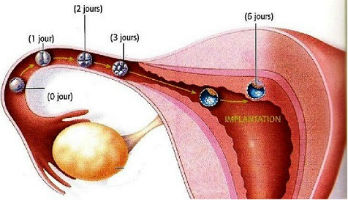
Il s'agit de récupérer les ovocytes, après un traitement de stimulation de l'ovulation, en ponctionnant directement les ovaires à travers la paroi vaginale et de les mettre en contact avec des spermatozoïdes afin d'obtenir des embryons que l'on transfert ensuite dans l'utérus. Les ovocytes peuvent être soit mis en présence de spermatozoïdes (c'est la FIV dite classique) soit micro-injectés par un spermatozoïde (c'est la FIV avec ICSI ou IMSI quand le choix du spermatozoïde se fait à un très fort grossissement) ; ces techniques seront expliquées plus loin.

II – QUELLES SONT LES INDICATIONS DE LA FIV ? ◊ la FIV classique peut être proposée dans les cas suivants : -
les trompes sont altérées, imperméables ou absentes -
le sperme est de qualité insuffisante pour réaliser des inséminations (IAC) -
dans les infertilités inexpliquées de longue durée ou après échec de différents traitements antérieurs (stimulation de l'ovulation, IAC) : on ne sait pas toujours pourquoi la FIV peut être efficace (correction d'atteintes tubaires ou spermatiques non détectées par les examens usuels?) mais c'est une constatation. ◊ l'ICSI peut être proposée dans les cas suivants : -
dans les infertilités masculines majeures, au cours desquelles le nombre de spermatozoïdes de bonne qualité disponibles après recueil est trop faible et ne permet pas une FIV classique. -
En cas d'azoospermie (absence totale de spermatozoïdes dans le sperme), par obstruction ou absence des voies génitales masculines qui assurent le transport des spermatozoïdes, ou suite à une altération sévère de la spermatogénèse (formation des spermatozoïdes). Dans ce cas, les spermatozoïdes sont recueillis dans l'épididyme ou le testicule lors d'une intervention chirurgicale. -
Après échecs répétés de la FIV classique ou en l'absence de fécondation en FIV classique alors que le sperme paraît peu altéré. ◊ l'IMSI sera préférée lorsqu'il existe une majorité de spermatozoïdes présentant des anomalies morphologiques au niveau de la tête.

III – LES ÉTAPES DU TRAITEMENT MÉDICAL DE LA FIV A) La stimulation de l'ovulation
Dans un cycle naturel, il n'y a ovulation que d'un seul ovocyte à chaque cycle ; en FIV, on assure le développement simultané de plusieurs follicules, afin de pouvoir disposer de plusieurs ovocytes. L'obtention de plusieurs ovocytes permet d'obtenir après fécondation plusieurs embryons de manière à augmenter les chances d'avoir au moins un embryon viable et donc une grossesse.
En début de cycle, un certain nombre de petits follicules sont sortis de leur état dormant et sont prêt à être recrutés (un peu comme les coureurs sélectionnés pour débuter une course) ; chaque follicule a besoin de plus ou moins de FSH (hormone sécrétée par le cerveau) pour grossir. Dans un cycle naturel, le cerveau envoie de petites doses de FSH, ce qui explique que seul le follicule le plus sensible grossit ; en FIV on effectue des injections quotidiennes de FSH à fortes doses, ce qui permet la croissance de plusieurs follicules.
Les ovocytes doivent être prélevés par ponction des ovaires avant toute ovulation spontanée. Il est donc nécessaire d'empêcher celle-ci par des médicaments spécifiques.
Le traitement pour la stimulation de l'ovulation consiste donc en des injections sous-cutanées quotidiennes de FSH pendant en moyenne 10-12 jours, associées à des injections d'un deuxième produit qui empêche l'ovulation. La surveillance du traitement est assurée par des échographies et des prises de sang régulières : c'est le monitorage de l'ovulation. Il existe différents protocoles de traitement.
ovaire stimulé par le traitement
B) Le déclenchement de l'ovulation et la ponction folliculaire
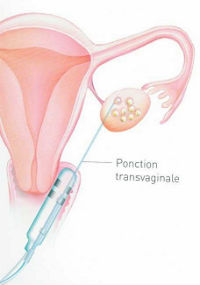 | | | Lorsque les follicules auront atteint une taille suffisante (environ 18 mm), une injection d'HCG sera effectuée. Celle-ci remplace le pic de LH qui se produit dans un cycle naturel et qui permet à l'ovocyte de finir sa maturation et l'ovulation.
En FIV, c'est uniquement le premier effet qui est recherché et le recueil des ovocytes est réalisé 36 heures après l'injection d'HCG, avant la rupture des follicules.
La ponction ovocytaire est réalisée par voie endovaginale, sous contrôle échographique, sous anesthésie générale ou locale ; elle consiste à aspirer le contenu des follicules.
|

IV – QUE SE PASSE-T-IL AU LABORATOIRE ? - J0 : le jour de la ponction ovocytaire
◊ Les ovocytes : après la ponction, les liquides folliculaires sont apportés au laboratoire. Les ovocytes sont recherchés sous une loupe. Ils sont ensuite transférés dans un tube ou une boîte de culture contenant un milieu nutritif. Chaque ovocyte est placé dans un incubateur à 37°C et dans des conditions de culture optimales. Environ une heure après l'arrivée du liquide de ponction au laboratoire, on peut connaître le nombre d'ovocytes recueillis. Il est en moyenne de 10 par ponction mais varie énormément, de 0 (1% des cas) à beaucoup plus ; les recueils supérieurs à 15 sont tout de même assez rares (5% des cas) et ceux supérieurs à 20 sont exceptionnels (1,5% des cas). ◊ Les spermatozoïdes : le recueil du sperme du conjoint par masturbation est réalisé le matin même de la ponction, au laboratoire de FIV, après une courte abstinence sexuelle.
Dans le cas où le prélèvement de spermatozoïdes doit s'effectuer par ponction dans le testicule ou dans l'épididyme, l'intervention peut se faire en même temps que la ponction ovocytaire (ponction synchrone), ou bien avant et dans ce cas les spermatozoïdes auront été congelés.
Dans certains cas, on sera amené à utiliser des spermatozoïdes issus de paillettes d'autoconservation (spermatozoïdes du conjoint congelés par exemple avant un traitement capable d'induire une stérilité comme une chimiothérapie) ou de donneurs (FIVD ou FIV avec donneur) ; les spermatozoïdes peuvent enfin être recueillis dans les urines, en cas d'éjaculation rétrograde (éjaculation vers la vessie en cas par exemple de paralysie). ∞ Cas où une FIV classique est réalisée : le sperme est préparé puis chaque ovocyte est mis en présence d'un nombre suffisant de spermatozoïdes mobiles (en moyenne 1 ovocyte pour 100 000 spermatozoïdes) avant d'être replacé à 37°C dans l'incubateur. La fécondation qui débute par l'union d'un spermatozoïde avec l'ovocyte et s'achève par la réunion des chromosomes maternels et paternels dure au moins une dizaine d'heures ; ce n'est donc pas un instant mais toute une cascade d’événements cellulaires, dépendants les uns des autres. Elle se déroule sans l'intervention du biologiste.
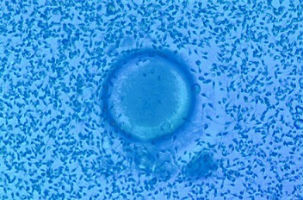
ovocyte entouré de spermatozoïdes
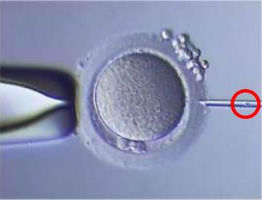
∞ Cas où une micro-injection ovocytaire est réalisée (ICSI ou IMSI) : les ovocytes sont débarrassés des cellules qui les entourent ; puis la fécondation par micro-injection est réalisée grâce l'aide d'un appareil de micromanipulation. L'ovocyte est maintenu grâce à une pipette pendant qu'un spermatozoïde est injecté dans l'ovocyte. L'ovocyte est ensuite immédiatement mis en culture.
Cette technique ne nécessite qu'un petit nombre de spermatozoïdes vivants, qu'ils soient mobiles ou non, théoriquement autant qu'il y a d'ovocytes à injecter.
En cas d'IMSI, on choisit un spermatozoïde grâce à un microscope à très fort grossissement (6600 fois contre 400 fois pour une analyse classique) et on procède ensuite à une micro-injection classique.
- J1 : le 1er jour après la ponction
Observation de la fécondation : le lendemain de la ponction, on transfère les œufs dans un nouveau milieu nutritif dépourvu de spermatozoïdes. A ce stade, on regarde au microscope si la fécondation a eu lieu. S'il y a eu fécondation, on peut voir le noyau mâle issu du spermatozoïde et le noyau femelle, issu de l’ovocyte, au centre de l’œuf : c'est le stade des 2 pronucléï ou pronoyaux, encore appelé zygote. 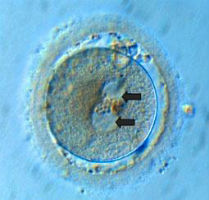 | | | En fait, ce n'est que 24 heures plus tard que l'on est certain de l'obtention ou non d'embryons, car à ce stade, l’œuf aura subi une ou plusieurs divisions et apparaîtra constitué de 2 à 4 cellules (4 en général).
L'observation des stades précoces de la fécondation est facile après micro-injection car l'ovocyte a été débarrassé des cellules qui l'entourent ; dans le cas d'une FIV classique, il faut attendre les divisions cellulaires, pour savoir s'il y a eu fécondation.
| - J2 : le 2ème jour après la ponction
Observation des embryons : à la fin de la fécondation, l’oeuf se divise en 2 cellules, puis 4, puis 8, et ainsi de suite. Il y aura environ 200 cellules au bout d’une semaine.
A J2 les embryons présentent 2 à 4 cellules, à J3 6 à 8 cellules ; à J5-J6 ils forment une cavité, c'est le stade de blastocyste.
Les embryons seront le plus souvent transférés à J2 ou J3 ; la culture jusqu'au stade de blastocyste implique l'utilisation de milieux spécifiques, dits milieux séquentiels.
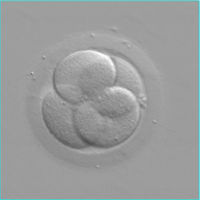 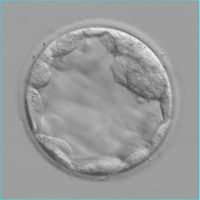
Transfert J2 : embryons 4 cellules Transfert J5 : blastocyste
L'analyse de l'aspect morphologique des embryons permet de les classer en 4 stades, en fonction de différents paramètres : nombre de cellules, régularité des cellules, présence de fragments. Les plus viables sont dits «top qualité».

V – LE TRANSFERT EMBRYONNAIRE
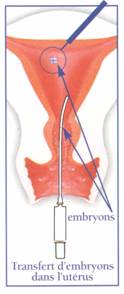 | | | Le transfert du ou des embryons est réalisé au moyen d’un cathéter souple et très fin contenant le ou les embryons.
Ce cathéter est introduit par le vagin dans l’utérus, la patiente étant allongée en position gynécologique. Le transfert d’embryons, geste indolore, ne nécessite ni anesthésie, ni hospitalisation.
Il est parfois réalisé sous contrôle échographique. Le cathéter est ensuite délicatement retiré puis la patiente reste au repos pendant un moment pour éviter d’éventuelles contractions utérines. Elle pourra à l’issue reprendre une vie normale, sans efforts trop violents.
| exemple de cathéters pour transfert embryonnaire 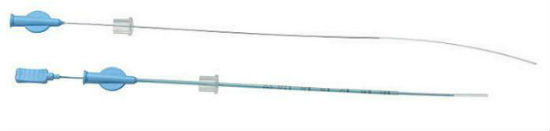
Le choix du nombre d’embryons transférés doit réaliser un compromis entre 2 objectifs contraires : transférer le plus possible d’embryons pour augmenter les chances de grossesse, en transférer le moins possible pour éviter les grossesses multiples. Il est décidé après discussion entre l’équipe biomédicale et le couple, en fonction de la probabilité d’implantation des embryons. Il est en général de 1 ou 2.
Un test de grossesse par dosage sanguin des βhCG est réalisé 14 à 15 jours après la ponction, et contrôlé 3-4 jours après en cas de positivité. La grossesse sera ensuite confirmée par échographie.

VI – LA CONGÉLATION EMBRYONNAIRE
- A quoi sert la congélation embryonnaire ?
Le ou les 2 meilleurs embryons sont transférés à la suite de la ponction ovocytaire. Les autres embryons, dits «surnuméraires» peuvent être congelés puis cryopréservés (c’est-à-dire conservés à très basse température) pour un transfert ultérieur. Cela permet de donner une ou des chance(s) supplémentaires au couple en l’absence de grossesse suite au transfert des embryons frais, sans avoir besoin de faire une nouvelle ponction.
Tous les embryons surnuméraires ne peuvent pas être congelés. Seuls ceux présentant les critères de viabilité identiques à ceux des embryons sélectionnés pour le transfert et ayant donc de vraies chances d’implantation sont congelés, ce qui représente selon les cas de 50 à 80% des embryons surnuméraires.
- Comment se passe la congélation ?
Tout d’abord le couple doit consentir, par écrit, à cette possibilité de cryopréserver ses embryons. Les embryons sélectionnés pour la congélation sont placés dans une solution cryoprotectrice (sorte d’antigel) qui les protège contre la formation de cristaux de glace intracellulaires qui pourraient les détruire. Puis ils sont placés dans une paillette fermée par un bouchon et portant une identification indélébile : nom du couple et nombre d’embryons. Ils sont ensuite refroidis progressivement avant d’être plongés dans l’azote liquide à – 196°C.
A cette température, toute activité cellulaire cesse et la vie est suspendue dans le temps. Généralement, on dépose 1 ou au maximum 2 embryons par paillette, de manière à pouvoir choisir ultérieurement le nombre d’embryons à transférer.
 | 
paillettes contenant les embryons congelés | - Combien de temps peut-on les conserver ainsi ?
Il n’y a pas à l’heure actuelle de durée limite pour la conservation des embryons cryopréservés. Ainsi des enfants sont nés en bonne santé après transfert d’embryons conservés pendant 12 ans. Le recul de plus de 30 ans pour les embryons d’origine animale montre que la durée de conservation n’a pas d’effet délétère sur le taux d’implantation ou sur la santé de la progéniture.
- Comment se passe la décongélation ?
L’accord du couple est indispensable avant chaque décongélation des embryons. Au moment choisi pour leur transfert, les embryons sont réchauffés, placés dans un milieu de culture de manière à éliminer la solution cryoprotectrice, puis transférés dans l’utérus.
Le cycle de transfert d’embryons congelés peut être, selon les équipes et le fonctionnement ovarien de chaque patiente, soit un cycle naturel, soit un cycle légèrement stimulé, soit un cycle artificiel. Le but est d’avoir un bel endomètre (couche qui tapisse l’intérieur de l’utérus et qui permet à l’embryon de s’implanter).
Il arrive que les embryons ne supportent pas la décongélation ; ils sont alors écartés du transfert. Seuls ceux présentant au moins 50% de cellules intactes sont transférés dans l’utérus. En effet, l’expérience montre qu’ils conservent de bonnes chances d’implantation.
- Quel est l’avenir des embryons congelés ?
La grande majorité des couples souhaite les conserver pour eux-mêmes afin de les utiliser en cas d’échec de la tentative de FIV ou pour une nouvelle grossesse. Chaque année, ils devront confirmer leur choix.
Les couples n’ayant plus de projet parental ont 3 possibilités. Ils peuvent :
- les donner à un autre couple
- les donner à la recherche biomédicale
- demander leur destruction
Après 5 ans, si le couple ne répond pas aux relances du laboratoire, ou en cas de désaccord entre les membres du couple, les embryons sont détruits.
- Le couple peut-il refuser la congélation ?
Oui, la congélation des embryons nécessite de la part des couples la signature d’un protocole d’accord. Ils ont donc tout à fait le droit de refuser.
Les motifs de refus les plus fréquents sont le manque d’information sur le risque de cette technique et sur la santé des enfants ; beaucoup changent donc d’avis après avoir discuté avec l’équipe médicale.
Pour les couples ayant choisi de ne pas congeler leurs embryons surnuméraires, comme on ne peut pas jeter des embryons, seul le nombre d’ovocytes correspondant au nombre d’embryons que l’on désire transférer dans l’utérus sera mis en fécondation. Cela signifie que si l’on désire transférer 1 ou 2 embryons, seuls 1 ou 2 ovocytes pourront être inséminés, ce qui conduira à 2, 1 ou … aucun embryon. Statistiquement, cela entraînera une diminution des chances de grossesse.
La Sécurité Sociale rembourse 4 tentatives. La tentative comptabilisée par la Sécurité Sociale est une ponction qui a donné lieu à un transfert d’embryon ; ne sont pas comptabilisés les arrêts en cours de traitement, les ponctions qui n’ont pas donné d’ovocyte ou d’embryon et les transferts d’embryons congelés. Au-delà de ces 4 tentatives, les couples qui souhaitent poursuivre doivent payer leur traitement.

VII – COMPRENDRE LES ÉCHECS DE LA FIV
Les chances de succès de la F.I.V. ne sont que de 20 à 25% par tentative (voir plus loin). Comment comprendre ce faible taux alors qu’une grande partie du “travail” est déjà fait et que les embryons replacés dans l’utérus n’ont plus qu’à s’implanter !
A) Les chances de succès sont fonction de la qualité des gamètes
- les anomalies chromosomiques : 25 à 30% des ovocytes sont proteurs d’anomalies chromosomiques. Ce taux augmente avec l’âge et certains facteurs comme le tabagisme.
- la maturité des ovocytes : une ponction contient un lot hétérogène d’ovocytes : certains sont parfaitement matures, d’autres le sont incomplètement, d’autres enfin sont totalement immatures. Les proportions de ces différentes catégories sont très variables d’une ponction à l’autre et il peut même se faire qu’il n’y ait aucun ovocyte parfaitement mature. On peut aussi trouver, rarement, des ovocytes “surmatures” quand le déclenchement de l’ovulation a été trop tardif.
Le monitorage de l’ovulation ne permet de savoir qu’imparfaitement la maturité ovocytaire : - en principe plus la taille d’un follicule est élevée (dans une certaine limite), plus l’ovocyte qu’il contient a des chances d’être mature
- plus le taux d’estradiol par follicule est élevé, plus on a de chances d’avoir des ovocytes matures.
On connaît par expérience des valeurs “seuils” au-dessous desquelles il n’y a pas d’ovocytes matures (le délenchement n’est en principe pas réalisé) et au-dessus desquelles la maturité ovocytaire peut être bonne ou moyenne.
La vitesse de croissance du taux d’estradiol et de la taille folliculaire est plus significative que les chiffres du jour du déclenchement ; si elle est trop lente ou trop rapide, le nombre d’ovocytes matures sera faible. Mais ces données n’apprécient que l’ensemble du lot d’ovocytes et n’apportent aucune information sur tel ou tel ovocyte.
En effet, les follicules recrutés par la stimulation se trouvent au départ à des stades différents de leur évolution et la stimulation n’arrivant qu’imparfaitement à synchroniser ces follicules (et donc les ovocytes qu’ils contiennent), cela explique l’hétérogénéité du lot. Au laboratoire, seuls les ovocytes totalement immatures (c’est-à-dire sans maturité nucléaire et donc sans globule polaire) peuvent être repérés. On peut cependant apprécier grossièrement la maturité d’ensemble du lot d’ovocytes : plus le nombre d’ovocytes avec maturité nucléaire (avec globule polaire) est élevé, plus il y a de chances que les autres ovocytes avec mature nucléaire soient parfaitement matures au plan cytoplasmique.
Enfin, plus le nombre d’ovocytes recueillis est proche du nombre de follicules de grande taille, plus il y a de chances que les ovocytes les plus matures aient été prélevés. Il faut savoir qu’il y a une grande part d’aléatoire dans la qualité de la réponse, mais parfois un changement de protocole ou de produit de stimulation peut entraîner à l’occasion d’une nouvelle tentative, une réponse de meilleure qualité.
Il ne faut également pas négliger les effets bénéfiques d’un arrêt du tabac, d’une perte de poids ou d’une prise en charge du stress.
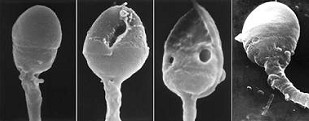
anomalies morphologiques des spermatozoïdes
- les anomalies chromosomiques : environ 10% des spermatozoïdes sont porteurs d’anomalies chromosomiques. Ce ne sont pas nécessairement les spermatozoïdes de forme atypique qui portent ces abérrations et il n’est pas certain que ces spermatozoïdes porteurs d’anomalies soient moins fécondants. Le taux d’anomalies s’élève lentement avec l’âge, avec certains toxiques comme le tabac et aussi avec la diminution de la qualité du sperme.
- le pouvoir fécondant du sperme : il exprime le pourcentage de spermatozoïdes fécondants. Cette propriété qu’on appelle fécondance permet à un spermatozoïde de rencontrer un ovocyte et de fusionner avec lui. Mais on ne sait pas reconnaître à coup sûr les spermatozoïdes fécondants. Il est faux de dire que le nombre et la mobilité des spermatozoïdes diminuant, il y aura toujours dans un sperme le ou les quelques spermatozoïdes fécondants. En réalité, la diminution du nombre et de la mobilité ne sont que les signes d’une baisse de fécondance. Donc dans les spermes de mauvaise qualité, il peut n’y avoir aucun spermatozoïde fécondant, bien qu’il y en ait encore d’apparemment normaux et mobiles.
Certains traitements (comme dans le cas d’une infection du sperme), l’utilisation de vitamines à visée antioxydante et l’arrêt de facteurs toxiques comme le tabac et l’alcool permettent souvent une amélioration des paramètres du sperme. Par contre les techniques de préparation du sperme au laboratoire ne permettent qu’une sélection des spermatozoïdes les plus fécondants ; en aucun cas elles ne permettent une amélioration de leur pouvoir fécondant.
B) Comprendre les échecs de fécondation Environ 60% seulement des ovocytes sont fécondés ; ce pourcentage définit ce qu’on appelle le taux de fécondation. Il peut en fait varier de 0 à 100%. Il y a 3 types de causes, isolées ou intriquées, qui peuvent expliquer les échecs de fécondation : l’état des ovocytes, la qualité du sperme et les problèmes techniques.
En règle générale, on peut dire qu’un ovocyte tout à fait mature est fécondable ; un ovocyte incomplètement mature a moins de chances de débuter une fécondation et s’il la débute, il a moins de chances de la terminer ; un ovocyte totalement immature a très peu de chances de débuter une fécondation et il ne la finira pas. Les ovocytes “surmatures” ou vieillis in vivo ou in vitro, sont aussi moins fécondables, mais ce cas de figure est moins fréquent. Les ovocytes “atrétiques”, c’est-à-dire ayant commencé un processus de dégénerescence avant la ponction ne sont pas fécondables.
En FIV classique, le taux de fécondation diminue avec la qualité du sperme. En ICSI, la qualité du sperme ne joue en principe pas, la fécondance étant court circuitée par la technique elle-même. Cependant les résultats semblent moins bons avec des spermatozoïdes immobiles.
En pratique 3 problèmes peuvent survenir : - le milieu de culture peut être infecté par une contamination bactérienne ; dans l’immense majorité des cas, celle-ci est causée par des bactéries présentes dans le sperme ; ceci touche moins d’ 1% des tentatives.
- des ovocytes peuvent être perdus ou endommagés par suite d’une déchirure de la zone pellucide, elle-même le plus souvent consécutive à des problèmes techniques de ponction (variation brutale de pression) ; ceci touche environ 1 % des ovocytes.
- en ICSI, la piqûre peut parfois endommager l’ovocyte ; ceci ne devrait toucher également que 2 % des ovocytes.
En FIV classique, il peut exister des échecs de fécondation inexpliqués, alors que tout paraissait normal. La tentative suivante sera donc faite par ICSI, en faisant l’hypothèse que l’on se trouve en présence d’une pathologie des enveloppes ou de la membrane ovocytaire ou d’un sperme non fécondant pour des raisons ignorées.
En ICSI, une bonne partie de ces cas réussissent, mais il existe néanmoins encore des échecs qui amèneront à abandonner.
Pour un couple donné, d’une tentative à l’autre, le taux de fécondation peut varier sensiblement, tant est variable la maturité du lot d’ovocytes.
Au total, même si ce taux de fécondation est variable, comme il y a presque toujours plusieurs ovocytes par tentative, il y a fécondation d’au moins 1 ovocyte dans 85 % des tentatives.
C) Les fécondations anormales En FIV classique, il existe un peu moins de 10 % des oeufs qui sont polyspermiques, conséquence de la fusion de plusieurs spermatozoïdes avec un ovocyte. Ceci est le plus souvent dû à un défaut de maturité ovocytaire, car il existe dans l’ovocyte mature des mécanismes de régulation empêchant la fusion d’un deuxième spermatozoïde. Plus rarement, le nombre de spermatozoïdes mis en présence d’un ovocyte est trop élevé, débordant ainsi les mécanismes de la régulation.
En ICSI, il y a quelques fausses fécondations : formation d’un oeuf sans intervention d’un spermatozoïde (parthénogénèse) due à la piqûre elle-même. On en trouve cependant aussi, en moindre quantité en FIV classique.
Ces fécondations anormales peuvent éventuellement être dépistées par le comptage des pronucléi (différent de 2) ; dans ce cas l’embryon est écarté. Cet examen n’est cependant pas toujours aisé.
Ces fécondations anormales peuvent donner des embryons d’apparence typique ou non, qui poursuivront leur évolution pendant un temps plus ou moins long. Mais de toutes façons, leur développement s’arrêtera spontanément.
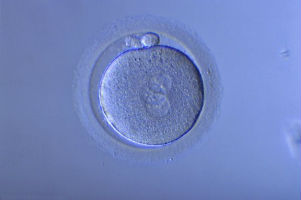
Zygote avec 3 pronucléi
D) La qualité embryonnaire : un embryon n'en vaut pas un autre
On a vu qu’en moyenne 60 % des ovocytes sont fécondés et qu’on obtient au moins un embryon dans 85 % des cas. Le nombre d’embryons obtenus varie en fonction du nombre initial d’ovocytes et du taux de fécondation.
Au bout de 2 jours, il est en moyenne de 4, mais il peut varier dans des proportions très importantes. Les chiffres supérieurs à 10 sont cependant rares (4% des tentatives) et les chiffres supérieurs à 15 exceptionnels (moins d’1 % des tentatives).
Si on laisse évoluer les embryons au stade blastocyte (5-6 jours), on obtient une sélection des embryons les plus viables, les autres arrêtant leur développement plus ou moins rapidement. L’intérêt est la sélection des embryons mais le risque est qu’il n’y ait pas d’embryons transférables, ce qui se produit dans 35 à 40 % des cas. Les embryons peuvent ne pas évoluer au stade blastocyte, soit parce qu’ils sont non viables, soit parce que les milieux de culture leur sont moins favorables que l’utérus. Cela explique que les taux de grossesse soient globalement similaires quand on transfère des embryons à J2-J3 ou des blastocytes.
E) Quelles sont les causes de non viabilité embryonnaire
- La présence d’anomalies chromosomiques
25 à 30 % des ovocytes et 10 % des spermatozoïdes portent des anomalies chromosomiques, 10 % des oeufs sont polyspermiques ou parthénogénétiques. Il y a donc au moins 50 % d’embryons porteurs d’anomalies chromosomiques. Ces embryons peuvent avoir la même forme, le même aspect et la même vitesse de développement (au cours des premiers stades) que les autres ; le taux d’anomalies chromosomiques est en revanche très élevé chez les embryons dont la forme est tout à fait atypique.
- Les embryons provenant d’ovocytes immatures
Les premiers stades de développement embryonnaire nécessitent la présence de substances élaborées par l’ovocyte avant l’ovulation, pendant sa phase de maturation. Si la maturité est imparfaite, ces substances font défaut et le développement sera compromis. L’immaturité ovocytaire peut aussi être cause d’anomalies chromosomiques. Le pourcentage de ces embryons peu viables est variable d’une tentative à l’autre mais il est en moyenne rarement < 20 %.
- Les embryons provenant de spermatozoïdes issus de spermes de très mauvaise qualité
La proportion d’embryons évoluant au stade blastocyte est également plus faible lorsqu’on utilise des spermes de très mauvaise qualité, et ce malgré l’ICSI, soit parce que les anomalies chromosomiques de ces spermatozoïdes sont plus nombreuses, soit parce que ces spermatozoïdes ne contiennent pas les éléments indispensables à la survie d’un embryon.
On peut apprécier, certe de manière imprécise, la viabilité d’ensemble du lot d’embryons obtenus : ainsi on a d’autant plus de chance d’avoir un ou plusieurs embryons viables que : - le taux de recueil est élevé,
- le taux de fécondation est élevé
- le nombre d’ovocytes totalement immatures est faible
- le nombre de beaux embryons de type 1 et 2 est élevé.
F) Les échecs de nidation ou d'implantation
Les échecs de nidation sont malheureusement très nombreux et peuvent être liés à la qualité des embryons ou à celle de l’utérus.
La qualité des embryons a déjà été vue au chapitre précédent ; celle de l’utérus est difficile à apprécier. L’analyse échographique (épaisseur et aspect de l’endomètre, vascularisation au doppler) ne permet qu’une approche approximative.
L’aptitude à la nidation dépend de différents facteurs : - l’âge de la femme : le taux de grossesse par ponction passe de 24% à 30 ans, à 14% à 40 ans et à 2% à 43 ans.
- la cause de l’infertilité : dans les infertilités masculines, le taux de nidation est plus élevé, du fait qu’en général dans ces cas, les conjointes sont normalement fertiles.
- la durée de l’infertilité : elle intervient uniquement dans les cas d’hypofertilités (tubaires, inexpliquées et masculines) où plus la durée d’infécondité est longue, plus les chances de nidation sont réduites. Dans les stérilités tubaires, la durée d’infécondité n’a pas de valeur pronostic, puisqu’il n’y a généralement jamais eu de fécondation spontanée.
- la présence de grossesse(s) antérieure(s) : le taux de nidation est plus important chez les femmes ayant déjà eu auparavant une ou des grossesse(s) spontanée(s) ou par FIV, menée(s) ou non à terme. Ce sont en effet des femmes “plutôt fertiles”.
- le rang de la tentative : plus le rang de la tentative s’élève, plus les chances de nidation diminuent. L’explication est que les femmes faisant la 5ème -6ème tentative ou plus sont évidemment moins fertiles que celles qui ont obtenu une grossesse à la 1ère ou la seconde FIV (c’est une sorte de sélection par l’echec). Pour un couple donné, les chances de succès restent les mêmes (sauf si l’âge de la femme dépasse 40 ans).
Donc plus l’aptitude à la nidation et plus la viabilité de l’ensemble des embryons sont bonnes, plus il y aura de chances de grossesse et donc de grossesse multiple.
L’interprétation de ces éléments permettra de décider du nombre d’embryons à transférer

VIII – LES RÉSULTATS DE LA FIV : DES CHIFFRES QUI REDONNENT ESPOIR

Les résultats sont en moyenne les suivants : - en FIV : 21 % de grossesse par ponction et 26 % par transfert d’embryon dont 75 % aboutiront à une naissance.
- en ICSI : 25 % de grossesse par ponction et 27 % par transfert d’embryon dont 80 % aboutiront à une naissance.
On peut exprimer les résultats soit en taux de grossesse ou d’accouchement par tentative, soit en taux cumulé et là les chiffres redonnent espoir !
Le taux cumulé est calculé de la façon suivante :
- à la 1ère FIV, sur 100 couples, 25 obtiennent une grossesse
- il en revient 75 pour une 2ème tentative ; le taux de succès est de 21%, donc 16 ont une grossesse. Le taux cumulé est donc de 25 +16 = 41 %
- il en revient 59 (100-41) pour une 3ème FIV dont le taux de succès est de 19% : donc 10 ont une grossesse. Le taux cumulé est donc de 25 +16 +10= 51%.
Et ainsi de suite ; on peut donc dire que sur 100 couples inclus dans un programme FIV, 51 % obtiendront une grossesse au bout de 3 tentatives.
Le taux cumulé théorique de grossesse clinique est de : 65 % à la 5ème FIV (au bout de 2 ans de traitement environ) et de 82 % à la 10ème FIV (au bout de 4 ans de traitement environ).
Comme il y a beaucoup d’arrêt du développement embryonnaire (fausse couche), il est préférable de tenir compte du taux cumulé d’accouchement. Le même calcul montre que : - au bout de 5 tentatives, 53 % des couples ont 1 enfant
- au bout de 10 tentatives, 70 % des couples ont 1 enfant.
Ce taux est théorique, car il suppose qu’aucun couple n’abandonne : ces chiffres expriment donc ce que donnerait la FIV si tous les couples persistaient jusqu’à obtenir satisfaction.
En réalité le taux d’abandon est de 20 à 25 % après chaque tentative et il est maximal après 4 tentatives, dans la mesure où c’est le nombre qui est remboursé par la Sécurité Sociale.
La tentative comptabilisée par la Sécurité Sociale est une ponction qui a donné lieu à un transfert d’embryon ; ne sont pas comptabilisés les arrêts en cours de traitement, les ponctions qui n’ont pas donné d’ovocyte ou d’embryon et les transferts d’embryons congelés.
Quel comportement adopter en cas d'échec ?
Dans les cas où la cause d’échec paraît hors de portée de la FIV ou de l’ICSI (très mauvais sperme, très mauvaise réponse ovarienne) le nombre de tentatives doit être limité à 1 ou 2.
Dans tous les autres cas, quand la cause de l’échec est difficile à préciser exactement, il faut garder espoir ! Il est en effet scientifiquement impossible de prédire la réussite ou l’échec pour les tentatives à venir.
Après un échec, il est cependant utile d’analyser la tentative et de se poser certaines questions :
- Est-il possible d’optimiser les chances par un arrêt du tabagisme des 2 conjoints (penser aussi au tabagisme passif) ou de l’alcool, une perte de poids par un régime adéquat et une augmentation de l’activité physique ?
- Est-il possible de diminuer le degré de stress par une prise en charge adaptée ?
- A-t-on intérêt à changer le protocole ou de produit de stimulation ?
- A-t-on intérêt à modifier la technique de laboratoire, par exemple passage en ICSI ou en IMSI ?
- Doit-on proposer d’autres examens, par exemple des analyses plus poussées du sperme, une hystéroscopie à la recherche d’une anomalie de la cavité, une coelioscopie à la recherche de lésions d’endométriose dont le traitement peut être bénéfique ?
Un compte-rendu détaillé de la tentative et une proposition de conduite à tenir (après concertation de l’équipe clinico-biologique) vous seront communiqués à l’issue de l’échec, et un nouvel essai pourra être tenté, après un repos ovarien de quelques cycles (le taux de grossesse diminue faiblement mais de manière significative si les tentatives sont trop rapprochées).

IX – QUELS SONT LES RISQUES ET COMPLICATIONS DE LA FIV ?
- L'hyperstimulation ovarienne
La première complication possible, mais rare, due à la stimulation de l’ovulation, est une réponse ovarienne excessive. Il existe différents degrés d’hyperstimulation ovarienne qui vont de la forme minime à la forme sévère, pouvant justifier l’hospitalisation. Il n’existe aucun risque d’hyperstimulation ovarienne tant que le déclenchement de l’ovulation n’a pas eu lieu.
C’est pour limiter ce risque que toutes les précautions sont prises pendant la surveilance de votre traitement, afin de contrôler la croissance folliculaire et la montée du taux d’estradiol. Le risque d’hyperstimulation est en effet d’autant plus important que le taux d’estradiol et surtout le nombre de follicules sont importants le jour du déclenchement. La valeur seuil pour le taux d’estradiol le jour du déclenchement est d’environ 4000 pg/ml.
Pour maîtriser l’augmentation du taux d’estradiol, on pourra être amené à diminuer les doses de gonadotrophines voire si besoin à stopper les injection : c’est la méthode du coasting. Cette technique permet un bon maintien des chances de grossesse à condition que le nombre de jours d’arrêt de stimulation n’excède pas 3 et que le taux d’estradiol ne chute pas trop.
Dans les autres cas (c’est-à-dire si le taux d’estradiol est vraiment trop élevé ou s’il ne baisse pas assez vite), on préfèrera arrêter la tentative et la fois suivante recommencer avec une dose de départ plus faible et/ou un autre protocole.
Dans les cas “limites”, où un déclenchement est cependant possible, un traitement pourra vous être proposé afin de diminuer les risques d’hyperstimulation ovarienne (ce traitement comprend en particulier un anticoagulant).
L’hyperstimulation ovarienne peut se manifester par des douleurs dans le bas ventre et une augmentation du volume de l’abdomen et, pour les formes plus sévères, des nausées ou vomissements, une prise de poids voire une gène respiratoire. Les autres complications liées à la ponction folliculaire ou au transfert embryonnaire sont exceptionnelles.
Contactez-moi rapidement si vous avez la moindre manifestation physique anormale, si besoin sur mon portable au : 06-82-42-16-69.
- La grossesse extra-utérine (GEU)
La FIV n’augmente pas le risque de GEU mais à l’inverse ce n’est pas parce que les embryons sont transférés dans l’utérus que le risque de GEU est écarté (il y a des petits “vicieux” qui ont la mauvaise idée de partir vers les trompes !)
Le risque est légèrement supérieur à celui de la population générale mais cela n’est pas dû à la technique. Cela tient en réalité aux caractéristiques de la population traitée (l’âge des patientes est en particulier souvent plus élevé).
- Le déroulement de la grossesse
La grossesse FIV ou ICSI est une grossesse comme les autres ; ainsi à âge égal et pathologique identique, le déroulement de la grossesse est le même que celui d’une grossesse spontanée.
Le taux d’anomalies chromosomiques et de malformations est en particulier le même que celui de la population générale. Il n’y a pas d’indication à faire une amniocentèse systématique, sauf si une anomalie équilibrée du caryotype a été découverte dans le bilan pré ICSI. En ICSI, il est néanmoins possible que cette hypofertilité masculine soit d’origine génétique et donc que les enfants issus d’une ICSI se retrouvent plus tard, dans certains cas encore mal connus, dans la même situation que leur père. - Le risque de grossesse multiple
 | | | Les grossesses gémellaires représentent environ 20 % des grossesses FIV contre 1 % dans la population générale. Il tend cependant à diminuer car de plus en plus de centres proposent le transfert d’un embryon unique, soit de façon systématique lors des premières tentatives, soit dans les cas où les chances de grossesse sont élevées. |
De la même manière, les grossesses triples et de rang supérieur sont devenues exceptionnelles et en fait moins fréquentes qu’après des stimulations de l’ovulation ou des inséminations artificielles.
Les risques de grossesses gémellaires obtenues par FIV sont les mêmes que ceux des grossesses gémellaires spontanées, et sont essentiellement liées à la prématurité.
Le recul est maintenant suffisant pour être sûr que les stimulations de l’ovulation n’augmentent pas les risques de cancer.
- Le risque d'épuisement ovarien
La stimulation de l’ovulation amène à maturité un certain nombre de follicules mais ces derniers avaient déjà entamé leur processus de recrutement et auraient été éliminés de toute façon. Les traitements de stimulation de l’ovulation ne sont donc pas responsables d’un avancement de l’âge de la ménopause ou de l’apparition d’une insuffisance ovarienne.

Ce document d’information a été réalisé avec l’aide des sites internet : Un bébé pour demain, L’Institut Médical de la Reproduction de Marseille, desirer-un-enfant, Natisens et avec les Laboratoires Merck Serono - Organon - Shering Plough - Genévrier
|