LE BILAN CHEZ L'HOMME  | | I – INTERROGATOIRE Il représente le temps principal de la consultation. Il s’attache à rechercher au niveau familial des antécédents d’infertilité, de cancers de l’appareil uro-génital et de maladies génétiques (chromosomes, mucoviscidose...).
Sur le plan personnel, en-dehors de l’interrogatoire habituel, on s’intéressera aux antécédents de chirurgie inguinoscrotale (hernie inguinale), à la notion de pathologies chroniques (diabète, affections respiratoires, neurologiques, psychiatriques...) et de prise médicamenteuse au long cours.
Sur le plan des antécédents andrologiques, on s’intéressera à tous les évènements susceptibles de perturber la fonction testiculaire, en particulier le traitement médical et/ou chirurgical de cryptorchidie uni ou bilatérale, les antécédents de chirurgie testiculaire ou d’infections urogénitales (orchiépididymites dans un contexte de MST, orchite ourlienne (oreillons), tuberculose génitale...). Il sera également utile de savoir si le patient a déjà fait la preuve de sa fertilité (avec sa partenaire actuelle ou avec d’autres).
Une intoxication tabagique sera systématiquement recherchée de même que les prises régulières de cannabis et d’alcool. Il faudra s’enquérir de la profession du patient pour rechercher une exposition excessive des testicules à la chaleur ou à d’autres toxiques (pesticides, solvants...), et se renseigner sur la pratique du sport (fréquence et type d’activité sportive).
Enfin, il faudra s’intéresser au déroulement et à la fréquence des rapports sexuels en recherchant des dysfonctions sexuelles masculines pouvant compromettre la fertilité du couple : dysfonction érectile, anéjaculation, dyspareunie, éjaculation précoce ... 
II – EXAMEN CLINIQUE Il sera réalisé par un urologue au moindre doute. Ce dernier s’attachera avant tout à rechercher des signes d’hypoandrisme, évoquant une atteinte de la fonction endocrine testiculaire (c’est-à-dire des signes témoignant d’un manque d’hormones mâles) : gynécomastie (présence de seins), diminution de la pilosité (fréquence de rasage du visage), fatigue, baisse de la libido, répartition gynoïde des graisses...
Le reste de l’examen est centré sur l’appareil urogénital : - la palpation des testicules avec évaluation du volume, de la consistance (normalement ferme) et recherche de nodule
- la palpation des épididymes à la recherche d’une dilatation évoquant un obstacle d’aval
- la présence ou non des canaux déférents au niveau du cordon
- la recherche d’une dilatation veineuse au niveau du cordon et du pôle supérieur du testicule (gauche le plus souvent), majorée en position debout et lors de la manoeuvre de valsalva (varicocèle)
- la taille de la verge et la position du méat urétral (hypospadias ?)
- un toucher rectal pour examiner la prostate et les vésicules séminales est recommandé en cas d’antécédents d’infection uro-génitale, de suspicion d’anomalie obstructive des voies génitales, de signes fonctionnels urinaires (dysurie) ou si l’âge du patient (plus de 50 ans) justifie un dépistage du cancer de la prostate.

III – LE SPERMOGRAMME  | | | L’analyse du sperme est l’examen le plus important dans l’évaluation de la fertilité masculine. Le spermogramme va permettre de détecter d’éventuelles anomalies dont les plus informatives concernent le nombre de spermatozoïdes, leur mobilité et leur forme.
| A) Prendre son courage à deux mains
Le recueil s’effectue au laboratoire par masturbation. Le prélèvement à domicile n’est pas conseillé, car le transport risque d’altérer les paramètres du sperme et de fausser les résultats. L’examen devra être précédé de 2 à 5 jours d’abstinence sexuelle. Le sperme est recueilli dans un récipient stérile fourni ; il convient de se laver les mains avant le recueil. L’homme est seul dans une pièce isolée. L’examen est évidemment un peu gênant mais absolument pas douloureux, contrairement à certains examens endurés par les femmes !
Pour éviter que cet examen ne devienne épique voire mission impossible, il est possible de se faire accompagner par sa conjointe. Cette aide vous sera certainement utile, tant l’environnement médicalisé ne possède pas un potentiel érotique exceptionnel. Mais rassurez-vous, l’accueil est le plus souvent très chaleureux et l’équipe médicale comprend tout à fait votre gêne.
B) Comprendre le spermogramme
1 - la viscosité : le sperme doit se liquéfier en moins de 30 minutes à 37°C.
2 - le PH (ou degré d’acidité du sperme) : il est généralement compris entre 7,2 et 8 et dépend de la sécrétion des glandes annexes. Un résultat anormal provient généralement d’une atteinte au niveau de ces glandes.
3 - le volume : le volume de l’éjaculat doit normalement être compris entre 2 et 6 ml. Un volume trop faible ou trop élevé témoigne d’un dysfonctionnement de la prostate et des vésicules séminales, et compte-tenu de l’interaction entre le plasma séminal et les spermatozoïdes, on peut facilement imaginer un effet délétère sur la mobilité et sur le pouvoir fécondant.
- Aspermie : absence d’éjaculat, voire pour certains, un volume < 0,5 ml. C’est souvent la conséquence d’une anéjéculation (absence d’éjaculation) ou d’une éjaculation rétrograde (éjaculation vers la vessie).
- Hypospermie : volume < 2 ml. Elle peut être la résultante d’un problème technique de recueil du sperme (non recueil de la totalité du sperme dans le récipient), d’un déficit de sécrétion des glandes (prostate, vésicules séminales), d’une éjaculation rétrograde partielle, ou d’un trouble de l’éjaculation (permanent ou simplement par spasme lié au stress du recueil). Un volume inférieur à 1,5 ml est en lui-même source de problème, essentiellement à cause d’un mauvais contact glaire/sperme. D’autre part, le sperme possède un pouvoir tampon, c’est-à-dire qu’il a pour rôle de neutraliser l’acidité vaginale (pH 3). Les petits volumes auraient en plus un pouvoir tampon diminué qui participerait également à l’infertilité.
- Hyperspermie : volume > 6 ml. Une augmentation du volume de l’éjaculat doit faire rechercher une infection des glandes annexes (vésicules séminales, prostate). Elle peut aussi être due à une abstinence trop longue. Au-delà de 6 ml, le volume peut jouer un rôle dans l’infertilité, par dissolution des spermatozoïdes, et évacuation trop rapide du sperme lors de la relation sexuelle (débordement vaginal).
4 - la numération des spermatozoïdes : le nombre de spermatozoïdes est normalement de 20 à 200 millions/ml.
- Azoopermie : aucun spermatozoïde n’est retrouvé.
- Oligospermie extrême ou cryptospermie : < 100 000/ml.
- Oligospermie sévère : < 5 millions/ml.
- Oligospermie : < 20 millions/ml. On estime que la fécondité naturelle n’est pas diminuée tant qu’il y a au moins 5 millions de spermatozoïdes de forme normale, bien mobiles par millilitre de sperme.
- Polyzoospermie ou polyspermie : > 200 millions/ml.
5 - la présence de cellules germinales ou cellules rondes : les cellules germinale sont les cellules de base qui évoluent vers le spermatozoïde après une transformation complexe. Le pourcentage de ces cellules dans le sperme ne doit pas dépasser 10%. Un taux supérieur doit faire penser à un trouble de la fabrication des spermatozoïdes.
6 - le taux de leucocytes ou globules blancs : le taux de leucocytes dans le sperme doit être inférieur à 1 millions/ml ; dans le cas contraire on parle de leucospermie qui est fréquemment un marqueur d’infection. Il est reconnu que la leucospermie a un effet néfaste sur la fécondance des spermatozoïdes.
7 - les agglutinats : la présence de spermatozoïdes agglutinés (en paquets) dans le sperme doit faire rechercher des anticorps antispermatozoïdes. A noter que ce sont les petits agglutinats qui sont pathologiques, les gros agglutinats étant simplement rencontrés lorsqu’il existe beaucoup de spermatozoïdes.
On estime que 3 à 15% des hommes infertiles en sont porteurs. Leur origine est mystérieuse. Elle est parfois due à une infection chronique des voies génitales, des séquelles d’intervention chirurgicale sur les voies génitales, un traumatisme à l’occasion d’un sport (football, rugby), le vélo peut être aussi être en cause, mais la plupart du temps, il n’y a aucune explication. La production d’anticorps anti-spermatozoïdes durera aussi longtemps que celle des spermatozoïdes eux-mêmes. Aucun traitement n’est connu à ce jour. Le test le plus simple consiste à doser les anticorps anti-spermatozoïdes dans le plasma séminal. Deux autres tests existent : le MAR test et le test aux immuno-billes et les anticorps peuvent également être recherchés dans la glaire cervicale de la femme. L’appréciation de leur taux et de leur localisation sont importantes : s’ils touchent principalement le flagelle, ils altèrent la mobilité des spermatozoïdes et on pourra dans ce cas proposer des inséminations si le taux n’est pas trop élevé ; s’ils touchent principalement la tête, ils empêchent la reconnaisance, la fusion et la pénétration des spermatozoïdes dans l’ovocyte, on s’orientera alors plutôt vers une FIV avec ICSI.
8 - la vitalité : c’est la proportion de spermatozoïdes vivants. elle doit être de 75% minimum. Si on a moins de 30% de spermatozoïdes vivants, on parle de nécrospermie. Elle est peut-être due à une infection ou un problème oxydatif. 9 - la mobilité : la mobilité des spermatozoïdes s’observe à différents temps : 1h et 3h après le recueil. On décrit différents types de mobilité : - classe a : spermatozoïdes rapides et progressifs
- classe b : spermatozoïdes lents ou faiblement progressifs
- classe c : spermatozoïdes mobiles et non progressifs
- classe d : spermatozoïdes immobiles.
On parle d’asthénospermie (diminution de la mobilité des spermatozoïdes) lorsque : - la mobilité progressive (a + b) est < 50% ou la mobilité rapide (a) est < 25% 1h après le recueil (asthénospermie ou AS primaire)
- la mobilité progressive est < 30% 3h après le recueil (AS secondaire).
L’asthénospermie peut avoir 3 origines : - une malformation au niveau du flagelle (interprétable à partir de la description des anomalies et pas toujours corrigeable) : flagelles enroulés (souvent signe indirect d’infection), angulation, pièce intermédiaire grêle ... L’anomalie peut n’être visible qu’au microscope électronique (après un grossissement de 1 million de fois) ; on parle alors d’anomalies ultra-structurales, pathologie rare.
- la présence d’anticorps anti-spermatozoïdes dirigés et fixés sur le flagelle, ce qui modifie l’amplitude du battement flagellaire et donc sa progressivité.
- une mauvaise qualité du plasma séminal (spermatozoïde bien constitué, pas d’anticorps). Le fait de placer les spermatozoïdes dans un milieu synthétique riche et approprié permet alors de booster leur mobilité, d’augmenter le pourcentage de bonne mobilité et d’utiliser l’insémination artificielle plutôt que la FIV.

spermatozoïdes immobiles 10 - le pourcentage de formes anormales : l’analyse des anomalies morphologiques des spermatozoïdes constitue le spermocytogramme. Le pourcentage de spermatozoïdes de forme normale doit être supérieure à 30%. En deçà, on parle de tératospermie. On classe les anomalies selon la partie atteinte du spermatozoïde : - les anomalies de la tête : spermatozoïdes microcéphales (petite tête), macrocéphales (grosse tête), à tête allongée, à tête irrégulière.
- les anomalies de la pièce intermédiaire
- les anomalies du flagelle : spermatozoïde à flagelle enroulé, angulé.
- les formes doubles.
L’absence d’acrosome ne permet pas la pénétration des spermatozoïdes dans l’ovule et impose une FIV avec microinjection (ICSI). Certaines anomalies peuvent être symptomatiques d’une pathologie dont le traitement peut améliorer le pourcentage de formes normales, ainsi les anomalies portant essentiellement sur la tête (surtout tête allongée et amincie) doivent faire rechercher la présence d’un varicocèle, la présence de nombreux flagelles enroulés doit faire rechercher une infection. En-dessous de 12% de formes typiques, la seule alternative est l’ICSI.
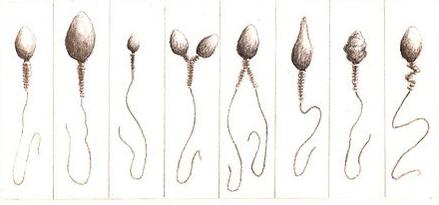 | | 1 2 3 4 5 6 7 8 | 1. normal - 2. macrocéphale - 3. microcéphale - 4. bicéphale - 5. deux flagelles
6. tête allongée - 7. anomalie de la tête - 8. anomalie de la pièce intermédiaire
3 notions à retenir : - Il existe, dans des conditions parfaitement normales, des fluctuations importantes des différents paramètres du sperme. Ceci résulte des conditions de prélèvement, du délai d’abstinence et de l’imprécision de certaines mesures. Une infection passagère qui s’accompagne de fièvre, le stress peuvent également avoir un impact. Un spermogramme anormal devra donc être renouvelé au minimum 3 mois plus tard (c’est la durée de fabrication des spermatozoïdes) afin de confirmer ou infirmer le premier résultat.
- Tous les laboratoires ne sont pas habitués à réaliser couramment des spermogrammes et l’examen peut se révéler incomplet voire faussement normal (sous-estimation des formes anormales par exemple). Il est donc indispensable de réaliser l’examen dans un laboratoire de référence, au risque d’être obligé de le répéter
- Les valeurs normales peuvent varier selon les sources. Celles citées ci-dessus sont celles de l’O.M.S. 1992.

IV – LES ANALYSES COMPLÉMENTAIRES SUR LE SPERME A) La spermoculture
C’est la mise en culture du sperme à la recherche d’une infection. On considère qu’il y a une infection lorsque la quantité de bactéries est ≥ 1 000 bactéries/ml : les mycoplasmes et les chlamydiaes sont recherchés grâce à des milieux de culture spécifiques. Une infection du sperme peut être à l’origine d’anomalies du spermogramme et peut compromettre les résultats d’une procrétion médicalement assistée ; elle se traite par antibiotiques.
B) l'étude biochimique du plasma séminal
Le plasma séminal contient des molécules qui, selon leurs concentrations, permettent d’étudier la vitalité des glandes annexes (vésicules séminales, prostate).
Cet examen est peu pratiqué et n’est pas nécessaire si le volume, le Ph et la viscosité du sperme sont normaux et si des spermatozoïdes sont présents dans l’éjaculat. C) Le test de migration survie des spermatozoïdes
Ce test (appelé TMS) permet d’isoler les spermatozoïdes mobiles et d’estimer leur survie à 24 heures. Il n’est pas réalisé en routine mais uniquement lorsqu’il existe une anomalie du spermogramme. Il est cependant indispensable car il permet d’orienter le choix thérapeutique.
- les IAC peuvent être proposées si l’on dispose après sélection d’au moins 1 million de spermatozoïdes mobiles rapides directionnels typiques dans 300 à 500 µl (ce volume correspond en fait à la quantité maximale de liquide injectable dans la cavité utérine).
- la FIV est possible si l’on dispose d’au moins 90 000 “bons” spermatozoïdes.
- l’ICSI est indiquée en-dessous de cette valeur et/ou si l’on a moins de 20% de mobilité directionnelle et/ou si l’on a moins de 12% de formes typiques.
La survie doit être positive : si elle est supérieure à 12% on peut proposer une FIV, en-dessous on préférera une ICSI. Chaque centre d’AMP peut cependant avoir des critères de choix très légèrement différents ; ces valeurs ne sont donc communiquées qu’à titre indicatif. D) Le test de fragmentation de l'ADN spermatique
L’ADN, support de l’information génétique contenue dans chacune de nos cellules, se présente sous la forme d’une longue pelote de laine, plus ou moins enroulée.
Dans chaque spermatozoïde, un certain pourcentage de la pelote est fragmenté. Après la fécondation, l’ovule utilise “sa boîte à outils” (des enzymes) pour réparer les chromosomes altérés. Au-delà d’un certain seuil, cette boîte à outils est dépassée et elle ne peut plus faire face aux réparations. La qualité de l’ovocyte (meilleure chez la femme jeune) est donc un paramètre très important. Un fort taux de fragmentation est dû à la présence de radicaux libres qui agressent le brin d’ADN et le détériorent. Ceci entraîne des répercussions sur le développement embryonnaire. Le test de fragmentation, qui apprécie cette proportion d’ADN altéré, devrait tendre à devenir un examen de première intention, même en cas de spermogramme normal. Il est cependant d’autant plus nécessaire qu’il existe des antécédents d’infection ou des facteurs environnementaux délétères.
Valeurs de référence :
- taux ≤ 13% : bonne qualité
- taux entre 14 et 29% : qualité moyenne
- taux ≥ 30% : mauvaise qualité et mauvais pronostic embryonnaire.
Le résultat peut être influencé par les situations suivantes : abstinence, leucospermie, âge, tabac, infections et fièvre, exposition aux rayons X ou UV, aux radiations électromagnétiques, prise de certains médicaments ou de toxiques, varicocèle, exposition à la chaleur, ...
Les solutions : - amélioration de toutes les situations qui peuvent l’être : arrêt du tabac, augmentation de la fréquence des rapports, traitement d’une infection ou d’un varicocèle, arrêt de certains médicaments, diminution de l’exposition à la chaleur ...
- la fragmentation élevée étant la conséquence de la présence de radicaux libres, un traitement à base d’antioxydants peut améliorer le résultat. Pour cette raison, des compléments vitaminiques vous seront fréquemment proposés (à noter qu’il convient d’éviter l’apport de vitamine C et de Sélénium qui bien qu’ayant un bon pouvoir antioxydant ont la propriété de favoriser la décompaction de la chromatine = “elles “déroulent” la pelote d’ADN alors que cette forme compactée permet à l’ADN de pas être dénaturée lors de son passage dans les voies génitales féminines).
- si le taux de fragmentation reste élevé après l’apport de ces “solutions” et un délai de 3 mois (temps de fabrication des spermatozoïdes), on pourra proposer une FIV avec IMSI, voire dans certains cas une biopsie testiculaire.
E) Le test pré-IMSI
Le principe de l’examen consiste à examiner les spermatozoïdes (à l’occasion d’un spermogramme classique) à l’aide d’un microscope spécial permettant d’obtenir un très fort grossissement (6600 fois contre 400 fois lors d’un examen classique).
Ce test sera surtout proposé en cas de tératospermie sévère ou d’asthénospermie, car il permet de réévaluer de façon beaucoup plus précise la morphologie spermatique et en particulier la tête du spermatozoïde, à la recherche de vacuoles (images ressemblant à des trous). L’examen permet de proposer d’emblée une technique IMSI, si une majorité de spermatozoïdes présentent des anomalies de leur tête. Cette technique peut également être utilisée soit d’emblée soit dans un deuxième temps dans les cas suivants : - âge élevé de l’homme
- tératospermie importante
- pauci fécondation après ICSI (peu d’embryons obtenus par rapport au nombre d’ovocytes)
- fausses-couches à répétition
- arrêt précoce dans la cinétique de division cellulaire de l’embryon
- mauvaise qualité embryonnaire (après 72h et/ou culture prolongée)
- indice de fragmentation de l’ADN spermatique élevé
- échecs répétés d’ICSI

V – L'ÉCHOGRAPHIE DE L'APPAREIL GÉNITAL MASCULIN
Cet examen est réalisé chez les hommes souffrant d’oligoasthénospermie ou d’azoospermie, ou présentant un faible volume d’éjaculat. Il est aussi prescrit lorsqu’on suspecte une infection génitale ou suite à un examen clinique peu concluant.
Il se pratique par voie externe afin d’observer les testicules et par voie interne (endorectale) pour observer la prostate. Bien sûr, cet examen n’est pas une partie de plaisir, mais il n’est pas douloureux ... c’est déjà ça !
A) L'échographie scrotale (examen des testicules)
Elle permet de contrôler le volume et la structure des testicules (homogène ou non), elle visualise les épididymes et recherche des foyers inflammatoires ou infectieux et des épanchements (rétention de liquides ou hydrocèles). Elle met en évidence les amas veineux ou varices au niveau du testicule (varicocèle)
En réalisant un écho-doppler scrotal (échographie combinée à l’analyse du flux sanguin), on peut encore mieux observer la structure des testicules et des canaux déférents. Un ralentissement du flux veineux peut induire un réchauffement des testicules et donc altérer la qualité des spermatozoïdes 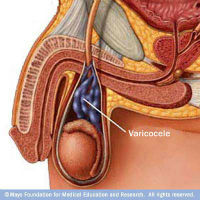
B) L'échographie prostatique
Elle permet de vérifier la présence d’éléments anatomiques qui peuvent parfois être absents (agénésie vésiculo-déférentielle par exemple : absence de vésicules séminales et de canaux déférents). Elle recherche un obstacle sur les voies excrétrices, un kyste, des calcifications.
L’examen du tissu glandulaire prostatique dépiste d’éventuels phénomènes inflammatoires.
Enfin, l’échographie rénale permet de détecter une malformation au niveau des reins, liée à une malformation génitale.

VI – LA RECHERCHE DE SPERMATOZOÏDES DANS LES URINES
En cas d’hypospermie, d’oligospermie ou même d’azoospermie, il faut envisager l’éventualité de l’éjaculation rétrograde (le sperme n’est pas déversé à l’extérieur mais reflue vers la vessie en totalité ou en partie). Ceci est d’autant plus vrai si le défaut du spermogramme est associé à des antécédents chirurgicaux du périnée ou à certaines maladies (neuropathie diabétique).
La recherche du sperme, et donc des spermatozoïdes dans les urines est le test à effectuer afin de vérifier cette hypothèse. C’est un examen très facile à réaliser. Il convient d’alcaniser les urines 2 à 3 jours avant sa réalisation. Pour cela, boire une eau adéquate (comme la Vichy Célestin par exemple) est suffisant. Ce test doit se réaliser debout, vessie pleine. Comme de nombreux examnes concernant les spermatozoïdes, celui-ci commence par un recueil d’éjaculat “classique”, c’est-à-dire par masturbation. Ensuite, il suffit d’uriner dans le récipient mis à disposition par le laboratoire. En cas d’éjaculation rétrograde complète, les urines présentent des filaments de protéines venant du sperme.
Ensuite, une analyse microscopique (avant et après centrifugation si nécessaire) va rechercher la présence (ou non) de spermatozoïdes.
L’évaluation du nombre de spermatozoïdes va permettre d’orienter le couple vers une IAC ou une FIV.

Dans la majorité des cas, c’est la présence d’une anomalie du spermogramme (en particulier une absence ou une diminution importante du nombre de spermatozoïdes) qui conduira à la réalisation d’un bilan hormonal.
Les causes hormonales d’infertilité sont rares (environ 1% des cas) ; il est cependant utile de les dépister car le traitement hormonal peut, dans certains cas, corriger les anomalies de la spermatogénèse et ainsi traiter l’infertilité.
A) La testostérone ou hormone mâle
Un taux circulant faible de testostérone a pour conséquence une faible imprégnation androgénique, c’est-à-dire en hormone mâle et définit l’hypogonadisme. Cela peut être la conséquence soit d’une insuffisance de sécrétion testiculaire, soit d’un défaut de stimulation des testicules par l’hypophyse (voir le chapitre anatomie), soit de certains traitements hormonaux (anti-androgènes, œstrogènes, androgènes de synthèse).
Les augmentations sont observées chez les patients traités par la testostérone, en cas d’hyperthyroïdie et dans le cas très rare d’une résistance aux androgènes (il existe un défaut du récepteur à la testostérone qui fait que les testicules sont insensibles à l’action de la testostérone).
La testostérone diminue de façon normale avec l’âge ; sa valeur normale doit être supérieur à 3 ng/ml et on parle d’hypogonadisme en dessous de 2 ng/ml.
La testostérone circule dans le sang liée à une protéine ; pour compléter le dosage de la testostérone, on peut aussi doser la testostérone libre et la testostérone biodisponible (testostérone libre plus testostérone faiblement liée à l’albumine) ; ce sont en effet ces formes qui sont actives.
Il est conseillé de faire le dosage le matin et d’éviter l’effort physique avant le prélèvement, car celui-ci augmente le taux de testostérone circulant.
B) L'hormone Folliculo-Stimulante (FSH)
Cette hormone, sécrétée par l’hypophyse (petite glande située à la base du cerveau) a pour rôle de stimuler les testicules et permettre la sécrétion de Testostérone et la fabrication des spermatozoïdes.
Sa valeur doit être comprise entre 1,5 et 10 UI/l. En temps normal, lorsque tout fonctionne bien, si la testostérone baisse, la FSH augmente pour “booster” les testicules ; à l’inverse lorsque le taux de testostérone augmente, cela envoi un message au cerveau pour lui dire qu’il y a assez de FSH (c’est ce que l’on appelle le rétrocontrôle négatif).
L’analyse du taux de testostérone et du taux de FSH permet de distinguer différents cas de figure : - testostérone diminuée et FSH basse ou normale : défaut de stimulation par l’hypophyse (hypogonadisme hypogonadotrope)
- testostérone diminuée et FSH augmentée : anomalie testiculaire (hypogonadisme testiculaire)
- testostérone augmentée et FSH augmentée : résistance aux androgènes
- testostérone normale et FSH normale : on recherchera dans ce cas un obstacle sur les voies spermatiques
C) La Prolactine
Un excès de prolactine peut être responsable d’une altération du sperme et d’une baisse de libido avec troubles de l’érection. La cause la plus fréquente est l’origine médicamenteuse. En l’absence de prise médicamenteuse ou d’insuffisance rénale, l’augmentation de la prolactine peut être liée à un adénome à prolactine (tumeur bénigne de l’hypophyse).
La sécrétion de prolactine est influencée par le stress et l’effort physique ; il vaut donc mieux faire le dosage le matin.
D) La TSH
Cette hormone est sécrétée par l’hypophyse et son rôle est de stimuler la thyroïde. C’est essentiellement l’hyperthyroïdie qui est responsable de perturbations du spermogramme (dans ce cas la TSH est basse) mais l’hypothyroïdie responsable de fatigue peut altérer la libido (dans ce cas la TSH est élevée).
B) L'Inhibine B
Il s’agit d’une protéine sécrétée par les cellules testiculaires ; sa valeur est corrélée à la concentration et la mobilité des spermatozoïdes éjaculés et au volume testiculaire. Le taux normal est de 94 à 327 g/ml.
VIII – LES EXAMENS GÉNÉTIQUES A) Le caryotype
Le caryotype est l’examen qui permet d’examiner les chromosomes de nos cellules ; les chromosomes sont identiques en nombre et aspect quelque soit la cellule choisie (sauf les spermatozoïdes et les ovocytes qui ont exactement la moitié des chromosomes par rapport à une autre cellule).
Il est prescrit en cas d’azoospermie sécrétoire (absence de spermatozoïdes par défaut de fabrication) et d’oligospermie sévère, en raison de la fréquence accrue d’anomalies génétiques dans ces cas. Il est également réalisé dans les situations d’échecs répétés.
Les cellules, obtenues par prise de sang, sont observées au microscope afin d’évaluer le nombre et la structure des chromosomes.
Les défauts de structure peuvent être des translocations (un morceau de chromosome se met sur un autre) ou des inversions (un morceau de chromosome est monté à l’envers).
Les cellules doivent contenir 23 paires de chromosome, dont la paire de chromosomes sexuels (XY chez l’homme et XX chez la femme)
Une des anomalies de nombre les plus courantes est le syndrome de Klinefelter : au lieu d’être porteur d’un chromosome Y et d’un X, les cellules contiennent un Y et deux X (XXY). Ces hommes présentent une atrophie testiculaire et une spermatogénèse altérée.
B) Recherche de microdélétions du chromosome Y
Le chromosome Y étant LE chromosome “responsable” de la différenciation homme / femme, il peut être intéressant de s’y intéresser de plus près, en cas d’azoospermie ou d’oligospermie sévère. Effectivement, 6 à 10% des hommes ayant une numération spermatique inférieure à 5 millions présentent des cassures significatives de leur chromosome Y.
L’examen de ce chromosome (après prise de sang) peut révéler des microdélétions (il manque un tout petit morceau du chromosome Y) ; on en rencontre dans près de 10% des azoospermies non obstructives et 5% des oligospermies sévères.
Selon l’endroit de la délétion (zone AZFa, b ou c), la conséquence est différente sur la spermatogénèse : en cas de délétions sur les zones AZFa et AZFb, la spermatogénèse est inexistante ; les délétions sur la zone AZFc sont plus fréquentes et selon l’étendue de la délétion, l’homme présente une azoospermie ou une oligospermie sévère. Dans ce dernier cas une fécondation in vitro avec ICSI est possible ; il y a néanmoins risque de transmettre cette altération chromosomique si l’enfant est un garçon.
C) Recherche de mutation du gène CFTR Lorsque l’azoospermie est liée à une agénésie (absence) bilatérale des canaux déférents, on recherchera des mutations (un morceau d’ADN à la place d’un autre) sur le gène CFTR, car elles sont souvent observées chez les porteurs du gène de la mucoviscidose. En cas de présence d’une mutation sur ce gène et dans l’éventualité d’une ICSI, il faut s’assurer que la conjointe n’en est pas porteuse pour éviter la transmission de la maladie à l’enfant. IX – LES PRÉLÈVEMENTS TESTICULAIRES : PONCTION ÉPIDIDYMAIRE ET BIOPSIE TESTICULAIRE Lorsque l’homme présente une azoospermie (absence de spermatozoïdes dans l’éjaculat), on peut réaliser un prélèvement chirurgical de spermatozoïdes pour effectuer une fécondation in vitro avec ICSI. La probabilité d’obtenir des spermatozoïdes dépend de la cause de l’azoospermie : - Les changes sont beaucoup plus élevées en cas d’azoospermie excrétoire (les spermatozoïdes sont fabriqués mais pas éliminés) notamment dans le cas d’agénésie vésiculo déférentielle ou en cas c’obstruction du canal éjaculateur (elles sont alors voisines de 100%). Dans ces cas-là, il est réalisé une ponction épididymaire à l’aiguille qui permettra de recueillir des spermatozoïdes qui seront congelés.
- Lorsqu’il s’agit d’une azoospermie sécrétoire (les spermatozoîdes ne sont pas correctement fabriqués), on réalise des biopsies testiculaires par prélèvement chirurgical de pulpe testiculaire qui sera analysée au laboratoire de biologie de la reproduction et qui permettra de récupérer les spermatozoïdes qui seront également congelés. Dans ce cas, les chances d’obtenir des spermatozoïdes sont plus aléatoire (de l’ordre de 50%). Il est cependant toujours préférable de vérifier par un prélèvement l’absence de spermatozoïde avant de proposer un recours au don de sperme.
Ces actes chirurgicaux sont réalisés sous anesthésie générale par un urologue, en sachant qu’une ponction épididymaire peut être convertie en biopsie testiculaire si la ponction revenait négative ou si les spermatozoïdes étaient de mauvaise qualité. Un biologiste de la reproduction est présent en salle d’opération, au cours du prélèvement, pour donner des informations au chirurgien. L’hospitalisation se fait en ambulatoire, le patient rentrant le matin et sortant dans l’après-midi avec son résultat. Un arrêt de travail de courte durée est généralement prescrit après l’intervention ainsi qu’une prescription d’antalgiques. Les complications sont rares et généralement sans conséquence avec une résorption spontanée de l’hématome. Les spermatozoïdes sont congelés et conservés dans des paillettes pour être utilisés lors d’une fécondation in vitro ultérieure (prélèvement de spermatozoïdes et ponction folliculaire asynchrones). Généralement un seul prélèvement permet d’obtenir plusieurs paillettes et sachant qu’une ou deux paillettes sont suffisantes pour réaliser une fécondation in vitro, la plupart du temps une seule ponction est nécessaire. Dans le cas contraire une nouvelle intervention peut être réalisée quelques mois après la première. Ce document d’information a été réalisé avec l’aide des sites internet : Un bébé pour demain, L’Institut Médical de la Reproduction de Marseille, desirer-un-enfant, Natisens et avec les Laboratoires Merck Serono - Organon - Shering Plough - Genévrier | Afficher la suite de cette page
|